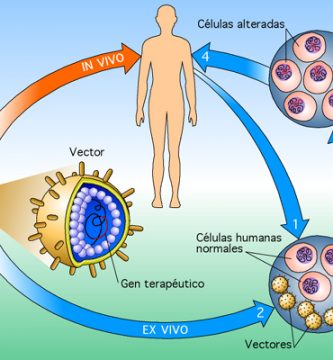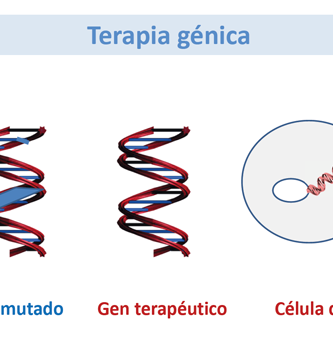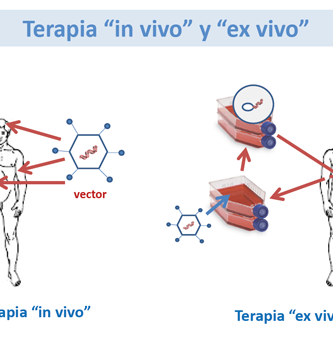
Los adenovirus son virus icosaédricos de tamaño mediano (90-100 nm), no envueltos (desnudos) compuestos por una nucleocápsida y un genoma de ADN lineal de doble cadena. Hay más de 51 diferentes serotipos en los seres humanos, que son responsables de 5-10% de las infecciones respiratorias en los niños, y muchas infecciones en los adultos también. Cuando estos virus infectan una célula huésped, introducen su molécula de ADN en el huésped. El material genético de los adenovirus no se incorpora (transitoriamente) al material genético de la célula huésped. La molécula de ADN se deja libre en el núcleo de la célula huésped, y las instrucciones en esta molécula extra de ADN se transcriben como cualquier otro gen. La única diferencia es que estos genes adicionales no se replican cuando la célula está a punto de sufrir la división celular por lo que los descendientes de esa célula no tendrá el gen extra.
Como resultado, el tratamiento con el adenovirus requerirá readministración en una población de células en crecimiento, aunque la ausencia de integración en el genoma de la célula huésped debe prevenir el tipo de cáncer observado en los ensayos de SCID. Este sistema de vectores ha mostrado una verdadera promesa en el tratamiento del cáncer y, de hecho, el primer producto de terapia génica (Gendicina) que se autoriza es un adenovirus para tratar el cáncer.
Virus de la familia Adenoviridae infectan varias especies de animales, incluyendo humanos. Los adenovirus se aislaron por primera vez en las adenoides humanas (amígdalas), de las cuales se deriva el nombre. Los adenovirus representan los virus no envueltos más grandes, porque son el tamaño máximo capaz de ser transportado a través del endosoma (es decir, la fusión de la envoltura no es necesaria). El virión también tiene una fibra única asociada con cada baseque ayuda a la unión a la célula huésped a través del receptor coxsackie-adenovirus en la superficie de la célula huésped.
Los adenovirus se propagan principalmente a través de gotitas respiratorias, sin embargo, también pueden propagarse por rutas fecales. La mayoría de las infecciones con adenovirus dan como resultado infecciones de las vías respiratorias superiores. Las infecciones por adenovirus suelen aparecer como conjuntivitis, amigdalitis, infección del oído. Los adenovirus también pueden causar gastroenteritis (gripe estomacal). Una combinación de conjuntivitis y amigdalitis es particularmente común con las infecciones por adenovirus. Algunos niños pueden desarrollar bronquiolitis de adenovirus o neumonía, los cuales pueden ser graves. En los bebés, los adenovirus también pueden causar ataques de tos que parecen casi exactamente como la tos ferina.
La mayoría de las personas se recuperan de las infecciones por adenovirus por sí mismas, pero las personas con inmunodeficiencia a veces mueren de infecciones por adenovirus y, rara vez, incluso personas previamente sanas pueden morir de estas infecciones. Los adenovirus son a menudo transmitidos por gotitas expulsadas por la tos, pero también pueden transmitirse por contacto con una persona infectada, o por partículas de virus dejadas en objetos tales como toallas y manijas de grifo.
La entrada de adenovirus en la célula huésped implica dos conjuntos de interacciones entre el virus y la célula huésped. La entrada en la célula huésped se inicia por el dominio de la proteína de fibra que se une al receptor celular. Los dos receptores actualmente establecidos son: CD46 para los serotipos de adenovirus humanos del grupo B y el receptor de adenovirus de coxsackievirus (CAR) para todos los otros serotipos. A esto le sigue una interacción secundaria, en la que un motivo especializado en la proteína base interactúa con una molécula de integrina. Es la interacción co-receptor que estimula la internalización del adenovirus. Esta molécula de co-receptor es integrina αv. La unión a la integrina αv da como resultado la endocitosis de la partícula vírica a través de fosas revestidas con clatrina. El apego a la integrina αv estimula la señalización celular y, por tanto, induce la polimerización de actina dando como resultado la entrada del virión en la célula huésped dentro de un endosoma.
Una vez que el virus ha logrado entrar con éxito en la célula huésped, el endosoma se acidifica, lo que altera la topología del virus al causar la disociación de los componentes de la cápside. Estos cambios, así como la naturaleza tóxica de los pentones da lugar a la liberación del virión en el citoplasma. Con la ayuda de microtúbulos celulares, el virus es transportado al complejo de poros nucleares por el que la partícula de adenovirus se desmonta. Luego se libera ADN viral que puede entrar en el núcleo a través del poro nuclear. Después de esto el ADN se asocia con moléculas de histona. Por lo tanto, la expresión génica viral puede ocurrir y se pueden generar nuevas partículas de virus.
El ciclo de vida del adenovirus se separa, mediante el proceso de replicación del ADN, en dos fases: una fase temprana y una fase tardía. En ambas fases se genera una transcripción primaria que se empalma alternativamente para generar mRNAs monocistrónicos compatibles con el ribosoma del huésped, permitiendo la traducción de los productos. Los genes tempranos son responsables de expresar principalmente las proteínas no estructurales, reguladoras. El objetivo de estas proteínas es triple: alterar la expresión de las proteínas huésped que son necesarias para la síntesis de ADN; Para activar otros genes de virus (tales como la DNA polimerasa codificada por virus); Y para evitar la muerte prematura de la célula infectada por las defensas inmunes al hospedador (bloqueo de la apoptosis, bloqueo de la actividad del interferón y bloqueo de la translocación y expresión del MHC de clase I).
Algunos adenovirus bajo condiciones especializadas pueden transformar células usando sus productos de genes tempranos. Se ha encontrado que E1a (se une a la proteína supresora de tumor de retinoblastoma) inmortaliza células primarias in vitro permitiendo que E1b (se une al supresor de tumores p53) para asistir y transformar de forma estable las células. Sin embargo, son dependientes entre sí para transformar con éxito la célula huésped y formar tumores. La replicación del ADN separa las fases temprana y tardía. Una vez que los genes tempranos han liberado proteínas adecuadas de virus, maquinaria de replicación y sustratos de replicación, puede producirse la replicación del genoma de adenovirus. Una proteína terminal que está unida covalentemente al extremo 5 del genoma del adenovirus actúa como un cebador para la replicación. La DNA polimerasa viral utiliza entonces un mecanismo de desplazamiento de hebras, en oposición a los fragmentos Okazaki convencionales utilizados en la replicación del ADN de mamífero, para replicar el genoma.
La entrada de adenovirus en la célula invitada implica los conjuntos de interacciones entre el virus y la célula huésped. La entrada en la célula huésped se inició por el control del dominio de la proteína de la fibra que se encuentra un receptor celular. Los dos receptores actualmente establecidos son: CD46 para los serotipos de adenovirus humanos del grupo B y el receptor de adenovirus de coxsackievirus (CAR) para todos los otros serotipos. A esto le sigue una interacción secundaria, en el que un motivo especializado en la proteína base de penton interactúa con una molécula de integrina. Es la interacción co-receptor que estimula la internalización del adenovirus. Esta molécula de co-receptor es integrina αv. La unión a la integridad y el resultado de la endocitación de la partícula vírica a través de fosas revestidas con clatrina. El apego a la integridad, estimula la señalización celular y por tanto, induce la polimerización de actina que da como resultado la entrada del viñón en la célula huésped dentro de un endosoma.
Una vez que el virus ha logrado entrar con éxito en la célula huésped, el endosoma se acidifica, lo que altera la topología del virus que causa la disociación de los componentes de la cápside. Estos cambios, así como la naturaleza tóxica de los pentones del lugar a la liberación del virión en el citoplasma. Con la ayuda de microtúbulos celulares, el virus es transportado al complejo de poros nucleares por el que la parte de adenovirus se desmonta. Luego se libera ADN viral que puede entrar en el núcleo a través del poro nuclear. Después de esto el ADN se asocia con las moléculas de histona. Por lo tanto, la expresión genética viral puede ocurrir y se pueden generar nuevas partículas de virus.
El ciclo de vida del adenovirus se separa, por el proceso de la réplica del ADN, en dos fases: una fase temprana y una fase tardía. En ambas fases se generan una transcripción primaria que se empalan alternativamente para generar mRNAs monocistrónicos compatibles con el ribosoma del huésped, permitiendo la traducción de los productos. Los genes tempranos son responsables de expresar principalmente las proteínas no estructurales, reguladoras. El objetivo de estas proteínas es triple: alterar la expresión de las proteínas que requieran su hijo para la síntesis de ADN; Para activar otros genes de virus (cuentos como la DNA polimerasa codificada por virus); Y para evitar la muerte prematura de la célula infectada por las defensas inmunes al hospedador (bloqueo de la apoptosis, bloqueo de la actividad del interferón y bloqueo de la translocación y la expresión del MHC de la clase I).