¿QUE ES TRANSGENESIS?
La transgénesis es el proceso de introducir un gen exógeno, llamado transgén, en un organismo vivo para que el organismo muestre una nueva propiedad y la transmita a su descendencia. • Transgén: es un gen o material genético que ha sido transferido de forma natural o mediante cualquiera de una serie de técnicas de ingeniería genética de un organismo a otro. • Plantas o animales transgénicos: las plantas o animales que expresan los caracteres codificados por el transgén se llaman plantas transgénicas o animales transgénicos.
VENTAJAS DE LA TRANSGÉNESIS
Más específicos: los científicos pueden elegir con mayor precisión el rasgo que desean establecer. El número de rasgos adicionales no deseados se puede mantener al mínimo. Más rápido: establecer el rasgo requiere solo una generación en comparación con las muchas generaciones que a menudo se necesitan para la cría selectiva tradicional, donde se deja mucho al azar. Más flexible: los rasgos que de otro modo no estarían disponibles en algunos animales o plantas pueden lograrse utilizando métodos transgénicos. Menos costoso: se podría evitar gran parte del costo y la mano de obra involucrados en la administración de suplementos alimenticios y tratamientos químicos para animales y cultivos.
4. Transferencia de genes mediada por células madre embrionarias
5. Este método implica la inserción previa de la secuencia de ADN deseada mediante recombinación homóloga en un cultivo in vitro de células madre embrionarias (ES). Las células madre son células indiferenciadas que tienen el potencial de diferenciarse en cualquier tipo de célula (células somáticas y germinales) y, por lo tanto, dar lugar a un organismo completo. Estas células se incorporan a un embrión en la etapa de desarrollo del blastocisto. El resultado es un animal quimérico. La transferencia génica mediada por células ES es el método de elección para la inactivación génica, el denominado método de inactivación. Esta técnica es de particular importancia para el estudio del control genético de los procesos de desarrollo. Esta técnica funciona particularmente bien en ratones. Tiene la ventaja de permitir el direccionamiento preciso de mutaciones definidas en el gen mediante recombinación homóloga.
TERAPIA GÉNICA
La terapia génica es una novedosa rama terapéutica de la medicina moderna. Su aparición es una consecuencia directa de la revolución anunciada por la introducción de la metodología del ADN recombinante en los años setenta. Originalmente, las enfermedades hereditarias monogénicas (aquellas causadas por defectos genéticos individuales heredados), como la fibrosis quística, se consideraban objetivos principales para la terapia génica. Por ejemplo, en estudios pioneros sobre la corrección de la deficiencia de adenosina desaminasa, se intentó una inmunodeficiencia combinada grave asociada a linfocitos (SCID). Aunque no se observó modulación de la función inmune, los datos de este estudio, junto con otros ensayos clínicos tempranos, demostraron la viabilidad potencial de los enfoques de transferencia de genes como estrategias terapéuticas efectivas.
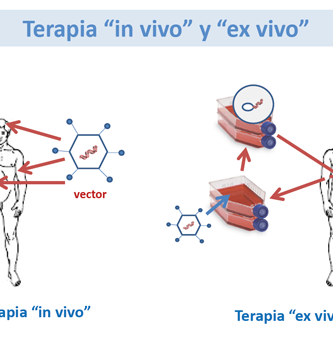
La transferencia directa de genes es particularmente atractiva debido a su relativa simplicidad. En este escenario, los genes se administran directamente en los tejidos o en el torrente sanguíneo del paciente mediante el empaquetamiento en liposomas (vasos esféricos compuestos por las moléculas que forman las membranas de las células) u otras micropartículas biológicas. Alternativamente, los genes se empaquetan en virus genéticamente modificados, como retrovirus o adenovirus. Debido a problemas de bioseguridad, los virus generalmente se modifican para que no sean tóxicos o infecciosos (es decir, son incompetentes para la replicación). Estas herramientas básicas de los terapeutas genéticos se han optimizado ampliamente en los últimos 10 años. Sin embargo, su mayor fortaleza, la simplicidad, es a la vez su mayor debilidad. En muchos casos, la transferencia directa de genes no permite un control muy sofisticado sobre el gen terapéutico. Esto se debe a que el gen transferido se integra al azar en los cromosomas del paciente o persiste sin estar integrado durante un período de tiempo relativamente corto en el tejido diana. Además, el órgano o tejido objetivo no siempre es fácilmente accesible para la aplicación directa del gen terapéutico.
TRANSFERENCIA DIRECTA
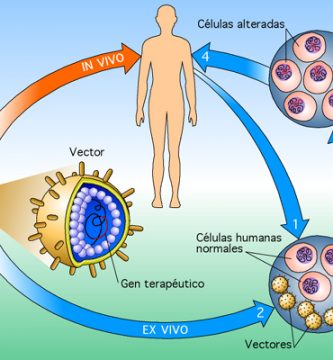
Los genes terapéuticos se pueden administrar utilizando células vivas. Este procedimiento es relativamente complejo en comparación con la transferencia directa de genes, y se puede dividir en tres pasos principales. 1.En el primer paso, las células del paciente u otras fuentes se aíslan y se propagan en el laboratorio. 2. el gen terapéutico se introduce en estas células, aplicando métodos similares a los utilizados en la transferencia directa de genes. 3. las células genéticamente modificadas se devuelven al paciente. El uso de células como vehículos de transferencia de genes tiene ciertas ventajas. En el plato de laboratorio (in vitro), las células se pueden manipular con mucha más precisión que en el cuerpo (in vivo). Algunos de los tipos de células que continúan dividiéndose en condiciones de laboratorio pueden expandirse significativamente antes de la reintroducción en el paciente.
CÉLULAS MADRE EMBRIONARIAS EN TERAPIA GÉNICA
Las células madre embrionarias humanas (hESCs) son líneas celulares derivadas de la masa celular interna de los blastocistos humanos. Se han derivado más de 120 líneas hESCs en todo el mundo que comparten las principales características de las células madre embrionarias de ratón (mESCs): autorrenovación, clonogenicidad y pluripotencialidad.
Este último rasgo puede proporcionar una fuente única e ilimitada de células para la terapia de reemplazo celular, y las dos anteriores hacen que estas células sean particularmente susceptibles a la ingeniería genética. Se han estudiado muchos métodos diferentes para dirigir la diferenciación de las ESC hacia linajes particulares. La mayoría se basa en el uso combinado de moléculas solubles, medios condicionados definidos y cocultivo con líneas de células alimentadoras.
Tales condiciones se han descrito para conducir la diferenciación de hESC a las neuronas, endodermo definitivo, cardiomiocitos, células hematopoyéticas, hepatocitos, células osteogénicas y células germinales. El enfoque tradicional de la terapia génica se ha dirigido principalmente a insertar una nueva copia de un gen bajo el control de un promotor exógeno. Este enfoque, también conocido como aumento de genes Las principales barreras para el aumento de genes son (1) las tasas de transducción de las células diana; (2) los riesgos asociados con la integración aleatoria; y (3) silenciamiento génico que puede ocurrir durante la vida de la célula.
El desarrollo de vectores lentivirales deficientes en replicación puede abordar algunos de estos problemas. también conocido como aumento de genes
Las principales barreras para el aumento de genes son (1) las tasas de transducción de las células diana; (2) los riesgos asociados con la integración aleatoria; y (3) silenciamiento génico que puede ocurrir durante la vida de la célula. El desarrollo de vectores lentivirales deficientes en replicación puede abordar algunos de estos problemas. también conocido como aumento de genes Las principales barreras para el aumento de genes son (1) las tasas de transducción de las células diana; (2) los riesgos asociados con la integración aleatoria; y (3) silenciamiento génico que puede ocurrir durante la vida de la célula. El desarrollo de vectores lentivirales deficientes en replicación puede abordar algunos de estos problemas.
TRANSFERENCIA DE GEN MEDIADA POR VIRUS RETROS
Un retrovirus es un virus de ARN monocatenario. • Tiene un tapón en el extremo 5 ‘y una cola de poli (A) en el extremo 3’. Elementos necesarios para generar virus defectuosos de replicación 1. Vector de transferencia: Secuencia de señal de transgén + empaquetado 2. Virus auxiliar (empaquetado del vector de transferencia): eliminada Secuencia de señal de empaquetado
Transferencia génica mediada por retrovirus
Para aumentar la probabilidad de expresión, la transferencia génica está mediada por medio de un vehículo o vector, generalmente un virus o un plásmido.
Los retrovirus se usan comúnmente como vectores para transferir material genético a la célula, aprovechando su capacidad para infectar las células del huésped de esta manera. Los descendientes derivados de este método son quiméricos, es decir, no todas las células portan el retrovirus. La transmisión del transgén solo es posible si el retrovirus se integra en algunas de las células germinales. El enfoque tradicional de la terapia génica se ha dirigido principalmente a insertar una nueva copia de un gen bajo el control de un promotor exógeno. Este enfoque, también conocido como aumento de genes, se ha utilizado con éxito en entornos preclínicos, pero ha encontrado muchos obstáculos cuando se usa para tratar pacientes con un retrovirus integrador.
TRANSFERENCIA DE GENES MEDIADOS POR EL VIRUS RETRO
La infección mediada por virus proporciona un medio rápido y eficiente para transferir material genético a los CES; sin embargo, los transgenes están sujetos a silenciamiento génico transcripcional progresivo que da como resultado una pérdida de expresión de variable a completa. Ciertos retrovirus modificados, como los vectores basados en el virus de células madre murinas, pueden resistir hasta cierto punto el silenciamiento transgénico. El desarrollo de lentivirus de pseudotipado deficientes en la replicación y autoactivadores utilizados en la terapia génica proporcionó una forma de introducir un gen en el genoma hES con mayor eficacia. Los vectores lentivirales también se han descrito para minimizar la aparición de silenciamiento en comparación con los retrovirus, pero no está claro si esto se debe a números totales de copias más altos en las células diana o a las características inherentes de los vectores basados en lentivirus, como la distribución de los sitios de integración en el genoma. Otra modificación de las construcciones lentivirales con nuevos elementos aislantes que bloquean el silenciamiento de la cromatina, para asegurar una expresión estabilizada de transgenes a lo largo de la diferenciación de ESC, ha sido particularmente alentador
MICROINYECCIÓN
Este método implica la microinyección directa de una construcción genética elegida (un solo gen o una combinación de genes) de otro miembro de la misma especie o de una especie diferente, en el pronúcleo de un óvulo fertilizado. El ADN introducido puede conducir a la expresión excesiva o insuficiente de ciertos genes o a la expresión de genes completamente nuevos para la especie animal. El constructo de ADN (generalmente de 100 a 200 copias en 2 μl de tampón) se introduce por microinyección a través de una aguja de vidrio fino en el pronúcleo masculino, el núcleo proporcionado por el esperma antes de la fusión con el núcleo del óvulo. El diámetro del huevo es de 70 μm y el de la aguja de vidrio de 0.75 μm; el experimentador realiza las manipulaciones con un microscopio binocular con un aumento de 200 x. La inserción de ADN es, sin embargo, un proceso aleatorio, y hay una alta probabilidad de que el gen introducido no se inserte en un sitio en el ADN del huésped que permita su expresión. El óvulo fertilizado manipulado se transfiere al oviducto de una hembra receptora, o madre adoptiva que ha sido inducida a actuar como receptora al aparearse con un macho vasectomizado.
Implicaciones positivas de la transgénesis: animales
El principal objetivo del uso de la tecnología transgénica en la agricultura animal es mejorar el ganado mediante la alteración de su bioquímica, su equilibrio hormonal o sus productos proteínicos importantes. Los científicos esperan producir animales más grandes y más delgados, que crezcan más rápido y sean más eficientes en el uso de alimentos, sean más productivos o más resistentes a las enfermedades. Algunos ejemplos de programas de reproducción transgénica incluyen: producción de cerdos de crecimiento más rápido y magros que usan los alimentos de manera más eficiente y resisten enfermedades comunes cría ovejas transgénicas que producen mejores lanas sin necesidad de suplementos dietéticos de aminoácidos que contienen azufre.
Implicaciones negativas de la transgénesis
La tecnología de GE conlleva cierta imprevisibilidad inherente Algunos hechos Aislamiento de un gen de su entorno natural e integración en un organismo completamente diferente Posible inestabilidad transgénica debido al desencadenamiento de los mecanismos de defensa incorporados del organismo huésped que conducen a la inactivación o silenciamiento de genes extraños.