Ha pasado más de un año desde que los oftalmólogos y científicos del equipo del Dr. Robin Ali en el Moorsfield Eye Hospital y el Instituto de Oftalmología del University College London, trataron con éxito pacientes con una enfermedad cegadora grave, la amaurosis congénita de Leber (LCA). ) usando terapia génica. Este éxito no parece ser transitorio, y este logro en el ensayo clínico de terapia de reemplazo génico para LCA ha infundido esperanza en numerosas familias con pacientes que padecen esta y otras enfermedades degenerativas de la retina, para quienes la restauración de la visión perdida ha sido un sueño distante hasta ahora . Se espera que el estímulo que ha dado este éxito también conduzca al inicio de ensayos clínicos para otras enfermedades oculares que causan ceguera, para las cuales los experimentos de terapia genética a nivel de laboratorio y de animales han tenido éxito.
Aunque la historia de la genética se remonta a más de un siglo, solo las últimas décadas, que abarcan la era del ADN y la genómica, han sido testigos de un avance en el trabajo de investigación que ha revolucionado varios campos, incluida la medicina. El único tratamiento posible que se predijo que estaría disponible para trastornos genéticos intratables era la terapia génica. El primer rayo de esperanza llegó en 1990, a través de la transducción retroviral exitosa del gen que codifica la adenosina desaminasa en Ashanti De Silva, de cuatro años, que padecía inmunodeficiencia combinada severa (SCID). Sin embargo, la confianza en la terapia génica se vio sacudida por la muerte de Jesse Gelsinger, de 18 años, en 1999 debido a una falla orgánica múltiple después de la administración sistémica de un vector adenovírico que tenía el gen de ornitina transcarbamilasa. A pesar de esto,1 ]
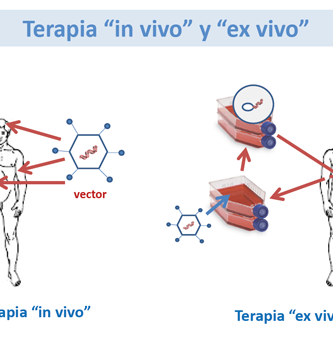
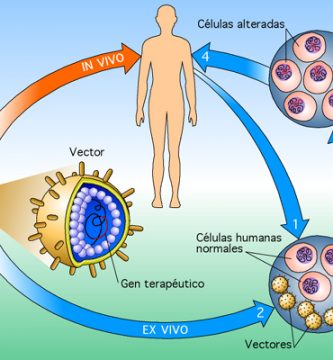
La investigación de la terapia génica ocular ha progresado rápidamente en los últimos años. Aunque los experimentos en laboratorio y en animales comenzaron con éxito hace muchos años, la aplicación en seres humanos tomó mucho tiempo debido a varios obstáculos biológicos y regulatorios. Sin embargo, los recientes ensayos clínicos exitosos de terapia génica son prometedores y alentadores. [ 2 ] Existen varios métodos que pueden emplearse para la terapia génica.
Reemplazo de genes
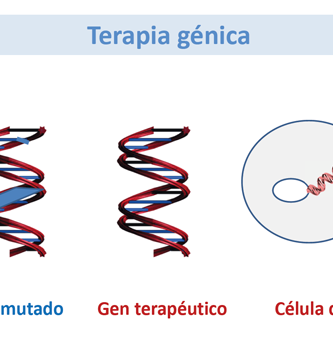
En los trastornos autosómicos recesivos como la amaurosis congénita de Leber (LCA), ambas copias del mismo gen están mutadas y producen una producción de proteína defectuosa, similar a un modelo animal knockout. En la terapia de reemplazo génico, un gen defectuoso (proteína) que causa la pérdida de función se reemplaza por una copia normal del gen (proteína) administrada al sitio de acción a través de un vector viral atenuado [ Tabla 1 ]. Acland et al realizaron exitosa terapia de reemplazo de genes RPE65 en modelos caninos naturales de LCA que dieron como resultado la restauración de la visión, un experimento histórico que llevó a los científicos clínicos a adoptar la estrategia para restaurar la visión en humanos con enfermedades degenerativas retinianas retinianas. [ 3 ]
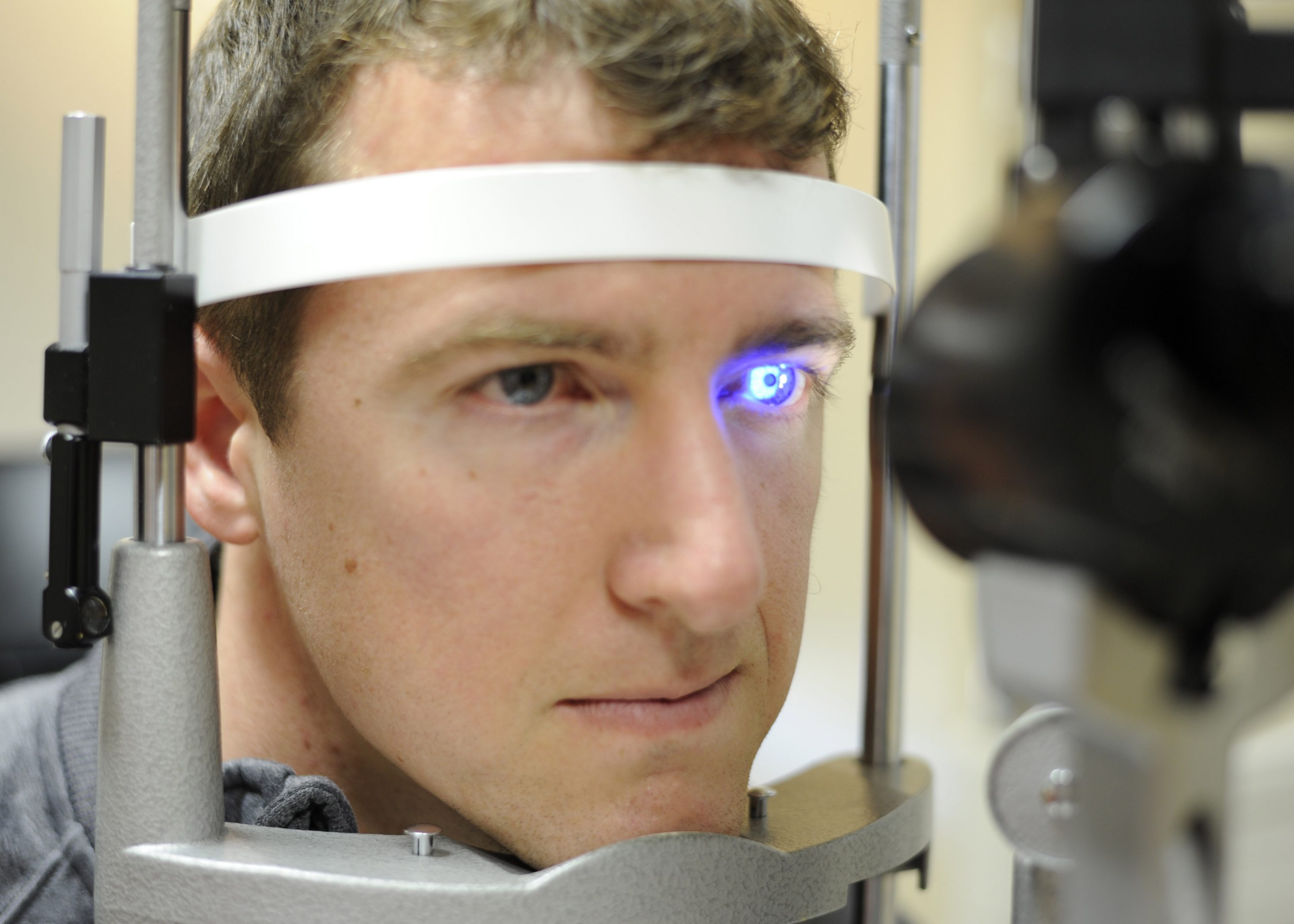
El primer ensayo clínico de terapia génica se inició en mayo de 2007 en el Instituto de Oftalmología y Moorfields Eye Hospital, Londres, Reino Unido. Tres pacientes adultos con LCA con distrofia retiniana severa de comienzo temprano, que tenían una mutación sin sentido en el gen RPE65 , recibieron una inyección subretiniana de vector de virus adenoasociado recombinante que expresaba ADN complementario RPE65 (ADNc) en un ojo, que tenía una agudeza visual peor; el ojo contralateral se usó como control. La función visual y el estado inmune se evaluaron después de dos, cuatro y seis meses y se clasificaron como puntos finales predefinidos para los efectos tóxicos y la eficacia para una mejor función visual. [ 2]] Excepto por la leve inflamación postoperatoria autolimitada intraocular, todos los pacientes estaban libres de efectos adversos. Aunque ninguno de los pacientes mostró ningún cambio en la respuesta de la retina a la electrorretinografía (ERG), se observó que uno de los pacientes tenía una mejoría significativa en la función visual y la movilidad. [ 2 ] Se llevaron a cabo ensayos similares con el Instituto Nacional del Ojo en las universidades de Pensilvania y Florida. [ 4 , 5 ] Después de tres meses de administración sub-retiniana del gen RPE65 mediado por vectores, los pacientes mostraron evidencia de aumento de la sensibilidad visual y activación del ciclo retinoide, sin embargo, con una cinética de reensibilización lenta de las barras, en comparación con el ojo control no tratado . [ 5] Un seguimiento de un año ha revelado que los pacientes no experimentaron disminución de la visión en comparación con el seguimiento a corto plazo, estableciendo el sustento del efecto de la terapia génica. [ 6 ] Estos ensayos también estuvieron libres de efectos adversos graves independientemente efectos de la entrega de genes basados en vectores, lo que demuestra su eficacia y seguridad.
Interferencia de ARN
Si bien el reemplazo génico es el método más adecuado para las enfermedades autosómicas recesivas donde no hay producción normal de proteínas, no es un método de elección para las enfermedades autosómicas dominantes (AD). En las enfermedades de EA hay una copia defectuosa que produce proteína mutante y una que produce proteína normal, lo que resulta en un efecto dominante negativo, donde las proteínas de tipo salvaje y mutante interactúan entre sí dando como resultado el bloqueo de la función proteica normal. El silenciamiento del ARN tiene como objetivo evitar que el gen mutante sea transcrito en ARN mensajero (ARNm) o evite que la transcripción del ARNm mutante se traduzca en una proteína [ Tabla 1].] El silenciamiento del ARN se logra mediante una serie de formas en las que el ARN de interferencia pequeño (ARNip) y la terapia con ribozimas son prometedores. Los ARNip son pequeños fragmentos de ARN que tienen una longitud de alrededor de 22 nucleótidos y complementarios al ARNm de interés. Se une a las proteínas celulares formando un complejo, donde desenrolla y dirige el ARNm con la guía del complejo y lo degrada por completo. Las ribozimas son moléculas de ARN que actúan como enzimas. En las enfermedades degenerativas de la retina AD, las ribozimas se dirigen a neutralizar la transcripción del ARNm mutado inhibiendo de este modo la interacción de la proteína mutante salvaje mediante el suministro de cadenas de ARN modificadas o unión específica del ARN ribozimático al ARNm codificado por el gen mutado o mediante la escisión del ARNm diana, evitando de ser traducido en una proteína.et al , desarrollaron una estrategia de reemplazo de supresión independiente de la mutación, que se ha evaluado en cultivos celulares in vitro con transcripciones derivadas de los genes de rodopsina y RDS-peripherina. [ 7 ]
Otros metodos :
Se están realizando experimentos con animales para el suministro de ADN usando nanopartículas. Recientemente, la transferencia mediada por nanopartículas del gen lento (Rds) de la degeneración de la retina en ratones rds +/- demostró ser un importante rescate estructural y bioquímico de la enfermedad. ERG mostró una mejora significativa en la función del cono y bastante buena respuesta de varilla. [ 8 ] En 2009, Gregory-Evans y cols. Demostraron en un modelo de rata de degeneración retiniana que la inyección intravítrea de células madre embrionarias secretorias del factor neorotrófico derivado de células gliales (GDNF) podría mantener el efecto neuroprotector en las estructuras retinianas durante al menos tres meses. [ 9 ]
La neovascularización ocular es la característica central en la patogénesis de las enfermedades oculares isquémicas, como la retinopatía del prematuro (ROP), la retinopatía diabética proliferativa (RDP) y la degeneración macular relacionada con la edad (DMAE). [ 10]] Mientras que la neovascularización ocurre en diferentes partes del ojo, como la córnea, el iris, la coroides y la retina, la neovascularización de la retina y la coroides adquieren importancia patológica esencialmente debido a su implicación en las retinopatías y la DMAE, respectivamente. El factor de crecimiento endotelial vascular (VEGF) es un modulador clave de la angiogénesis y se ha demostrado que se expresa en exceso en enfermedades oculares en las que la angiogénesis es la característica principal. La inhibición de VEGF en un modelo murino a través de la transferencia mediada por el virus adenoasociado recombinante (rAAV) del gen que codifica su receptor, el receptor 1 de VEGF soluble (sFlt-1) ha demostrado reducir la neovascularización retinal en un 50%. [ 10 , 11De manera similar, se ha demostrado que el ARNip que se dirige a VEGF reduce la neovascularización retiniana en líneas celulares humanas y después de la expresión transgénica inducida por adenovirus de hVEGF en modelos de ratón. También se demostró que reduce la neovascularización coroidea inducida por láser, que a menudo se nota en la DMAE. [ 12 ] Se demostró que la transferencia génica mediada por AAV del factor derivado del epitelio pigmentario (PEDF) reduce significativamente la neovascularización coroidal en ratones expuestos al láser para Ruptura de la membrana de Bruch. [ 13 ] Se están llevando a cabo ensayos preclínicos y clínicos utilizando las técnicas mencionadas anteriormente para otras moléculas implicadas en la neovascularización ocular, como la proteína quinasa C (PKC) -β, angiopoyetina-1, metaloproteinasa-3, etc. , en una escala tan masiva que está más allá del alcance de esta revisión.
El futuro
El reciente éxito de la terapia de reemplazo génico para LCA es un gran paso adelante en el campo de la medicina genómica. Estos resultados han entusiasmado a la comunidad médica y a los científicos básicos por igual y han revelado las posibilidades que están reservadas para el futuro de la medicina. Una vez que estos experimentos se refinan y adaptan a las necesidades de estos pacientes con éxito inequívoco, casi 500 enfermedades genéticas oculares y 1500 enfermedades genéticas en otras partes del cuerpo podrían ser potencialmente curadas.