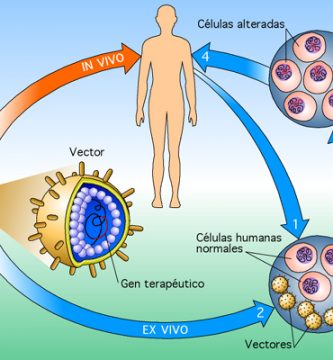
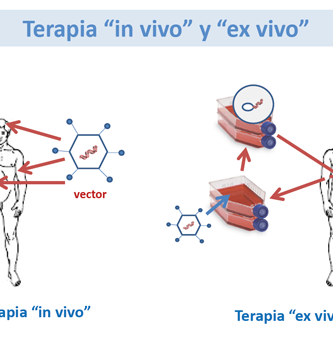
La terapia génica es una técnica que implica la inserción de genes exógenos correctores en el material genético de las células de un paciente para compensar genes anormales o para administrar una proteína beneficiosa como tratamiento para una enfermedad. En la actualidad, la terapia génica no se considera solo como un enfoque para tratar enfermedades hereditarias; también se reconoce ampliamente su papel potencial en el tratamiento de enfermedades adquiridas, como el cáncer y otras afecciones terminales o gravemente incapacitantes.
Este tipo de terapia aún se encuentra en etapas experimentales y, por lo tanto, su uso aún no está muy extendido, pero los ensayos clínicos recientes han demostrado beneficios terapéuticos notables y un excelente historial de seguridad.
Detrás de estos avances se encuentran diseños mejorados de vectores virales y no virales que permiten la entrega segura de genes terapéuticos a células específicas, tecnologías para editar genes y corregir mutaciones, el uso de células madre para regenerar tejidos y la explotación efectiva de respuestas inmunes fuertes.
Sin embargo, a medida que la tecnología avanza rápidamente y se están desarrollando nuevas y mejores opciones en terapia génica, el marco legal se deja atrás, particularmente en países en desarrollo como México y otros en América Latina.
Elegibilidad de patente
Desde la perspectiva de IP, la elegibilidad de la patente se ve comprometida por varias razones. Un número significativo de alternativas de terapia génica requieren un procedimiento quirúrgico para lograr la modificación genética deseada, y los métodos terapéuticos quirúrgicos pueden excluirse de la patentabilidad en virtud de tratados internacionales y leyes locales, como es el caso en la legislación mexicana.
Debido a que los desafíos científicos están más del lado de los procedimientos y métodos de entrega que en el lado de las composiciones o materiales, cuando no hay un componente tangible tal como una composición, una línea celular, un nuevo vector o similar para reclamar como composición de la materia, en la mayoría de los países donde los métodos terapéuticos no son elegibles para la patente, la protección de las terapias genéticas puede estar en riesgo.
Por consiguiente, una estrategia de protección debe incluir otros elementos patentables de terapia génica tales como dispositivos médicos, materiales biológicos, formulaciones y métodos de ensayo en torno a la terapia, pero también otros elementos IP más suaves como derechos de autor y marcas registradas, como se explica a continuación.
Debido a los riesgos y el nivel de sofisticación que implican las terapias genéticas, la mayoría de las terapias no se venden como un producto farmacéutico típico que consume el usuario bajo prescripción médica. Por lo general, la terapia génica requerirá servicios médicos y de otro tipo para los pacientes e incluso sus familias, y por lo tanto los derechos de autor sobre la información proporcionada a los pacientes, así como el cambio de los elementos distintivos de los servicios, son extremadamente importantes para una adecuada estrategia de IP de terapia génica, porque el modelo comercial puede incluir otros servicios médicos como hospitales, clínicas y laboratorios.
Haciendo las reglas
En el ámbito regulatorio, también hay muchas incertidumbres. Los criterios y la evaluación de la seguridad y la eficacia de la terapia génica junto con otros desarrollos en biotecnología no están bien definidos, lo que crea un camino regulador poco claro y arriesgado para las empresas innovadoras. Sin embargo, si estos asuntos se resuelven adecuadamente, México, dada su proximidad geográfica con los EE. UU., Podría tener la oportunidad de convertirse en un importante centro estratégico de desarrollo farmacéutico.
De hecho, a pesar de que México fue uno de los primeros países en introducir nuevas reglamentaciones sobre medicamentos biotecnológicos en general en 2009, todavía no existen pautas normativas específicas para la terapia genética en México. Por lo tanto, actualmente, con base en el marco legal mexicano, para fines de aprobación de la salud, la terapia génica podría considerarse como un nuevo medicamento biotecnológico.
Según el artículo 222bis de la Ley General de Salud (GHL), los medicamentos biotecnológicos se definen como “cualquier sustancia producida por biotecnología molecular que tenga un efecto terapéutico, ya sea profiláctico o de rehabilitación, que se identifica como tal por su actividad farmacológica y física, química y propiedades biológicas “.
Además de ese artículo, los medicamentos biotecnológicos están regulados por el Reglamento de Suministros de Salud (requisitos básicos de aprobación para innovadores y medicamentos biosimilares, conocidos en México como medicamentos “biocomparables”), normas oficiales mexicanas NOM-177-SSA1-2013 (requisitos para realizar estudios de bio-comparabilidad), y NOM-257-SSA1-2014 (conjunto detallado e integral de los requisitos de las normas de aprobación para medicamentos biotecnológicos).
Otras normas aplicables para la terapia génica son las Regulaciones del GHL sobre Investigación en Salud, Regulaciones del GHL sobre Servicios de Atención Médica, Regulaciones del GHL sobre Publicidad, estándares oficiales mexicanos NOM-059-SSA1-2015 (buenas prácticas de fabricación para producir drogas), NOM-164-SSA1-2013 (buenas prácticas de fabricación para la producción de principios activos), NOM-072-SSA1-2012 (etiquetado), NOM-220-SSA1-2012 (vigilancia farmacéutica) y NOM-073-SSA1-2005 (medicamentos) estabilidad). Todas estas reglas citadas deben ser consideradas para la aprobación regulatoria.
En general, para la aprobación de medicamentos biotecnológicos en la salud, el tipo de información que se presentará a la agencia reguladora en México, la Comisión Federal para la Prevención de Riesgos Sanitarios (COFEPRIS), es la misma que la requerida por la mayoría de En todo el mundo, los solicitantes de medicamentos biotecnológicos o cualquier medicamento nuevo que contenga nuevos compuestos, indicaciones o formulaciones deben solicitar antes de iniciar el procedimiento formal de la COFEPRIS, solicitantes de medicamentos biotecnológicos o cualquier medicamento nuevo que contenga nuevos compuestos, indicaciones o formulaciones. una reunión con el Comité de Nuevas Moléculas (NMC), que revisará en primera instancia la información clínica relacionada con el nuevo medicamento y definirá de antemano el tipo de ensayos o información que se requerirá para obtener la aprobación del medicamento. Especialista inputThe NMC es un organismo de consulta de COFEPRIS con respecto a la información de seguridad, calidad y efectividad de difieren suministros de salud que debido a sus características requieren una evaluación por un grupo de especialistas diversos.