Aplicaciones en Odontología
La pérdida ósea causada por trauma, neoplasia, cirugía reconstructiva, defectos congénitos o enfermedad periodontal es un importante problema de salud en todo el mundo. La regeneración de estas estructuras óseas sería enormemente útil en el tratamiento de anomalías craneofaciales y otras anomalías óseas, pérdida de dientes, enfermedades temporomandibulares y otras articulaciones, amputaciones traumáticas y las consecuencias de la resección tumoral Las proteínas morfogénicas óseas (BMP) permiten la formación de tejido esquelético durante la embriogénesis, el crecimiento, la edad adulta y la curación. Probablemente las BMP (BMPs 2, 4 y 7) son los únicos factores de crecimiento que pueden inducir individualmente la formación ósea de nuevo tanto in vitro como en sitios heterotópicos. Los defectos óseos en la región oral y maxilofacial pueden repararse mediante la transferencia de genes que codifican BMP (proteína morfogénica ósea) . Será posible administrar directamente el gen BMP-2 in vivo a los tejidos a través de un vector adenoviral para curar los defectos óseos . En un estudio, las células madre mesenquimales modificadas genéticamente que expresan BMP-2 indujeron una mayor formación de nuevos vasos sanguíneos y hueso nuevo . El grupo de investigación de Michigan descubrió que los fibroblastos no osteogénicos (gingiva, pulpa dental) expresan el gen BMP-7 después de ser infectados con un vector adenoviral. Las BMP son agentes bien establecidos en la inducción de la formación ósea ortotópica y ectópica. En estudios ex vivo, los investigadores logran la transferencia de genes real en un entorno de cultivo de tejidos y luego colocan las células transducidas que llevan los genes extraños de vuelta al huésped . La transferencia del gen del factor de crecimiento derivado de plaquetas a las células periodontales da como resultado la síntesis de ADN y la proliferación celular. Se ha demostrado que la administración de PDGF mediante transferencia genética estimula la mitogénesis y proliferación de fibroblastos gingivales, PDL y células de revestimiento dental (cementoblastos) por encima de la administración continua de PDGF in vitro. PDGF también ha demostrado efectos positivos en la regeneración del hueso alrededor de los dientes y los implantes dentales . Esto facilitará la regeneración localizada del hueso para procedimientos quirúrgicos periodontales y orales. La sialoproteína ósea (BSP) es una proteína importante no colágena en el hueso y otros tejidos mineralizados. Mediante la administración in vivo de un gen BSP en un defecto óseo, se ha demostrado que regenera el hueso alveolar periodontal .Los estudios han demostrado el uso potencial de la administración de genes para regenerar el hueso alveolar y el cemento alrededor de los dientes y el hueso alveolar asociado con los implantes dentales .
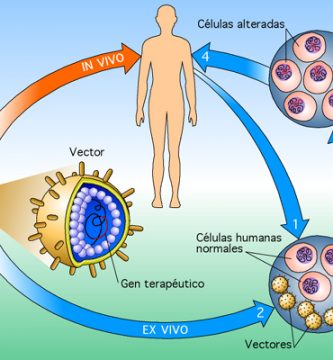
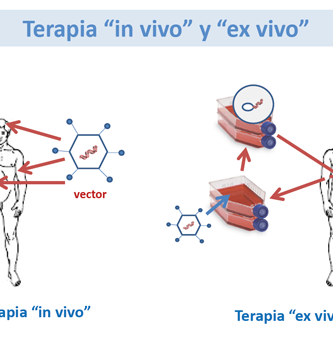
Transferencia génica ex vivo para reparación ósea
La ventaja de un enfoque de transferencia génica ex vivo es que células específicas como células de médula ósea o células madre pueden seleccionarse como el vehículo de administración celular para problemas clínicos específicos. Además, las estrategias ex vivo tienen una alta eficacia de transducción celular. Es posible recolectar células del paciente, tener un período de infección muy corto y reimplantar las células transducidas en el sitio anatómico apropiado. Las células que han recibido más interés como vehículo de entrega celular son las células madre mesenquimales, las células madre derivadas de los músculos, las células madre derivadas del tejido adiposo, las células de la cubierta leucocitaria de la médula ósea o los fibroblastos de la sangre y la piel . los genes pueden mejorar la reparación ósea.
Ingeniería de tejidos
Los constructos génicos, tales como el ADN plasmídico o una partícula viral, están físicamente atrapados dentro de una matriz. Cuando esta matriz / andamio se implanta en los defectos del tejido, las células del huésped migran hacia el implante, toman la construcción del gen y comienzan a producir la proteína codificada .
Dolor
Administrar o eliminar el dolor es una parte importante de la práctica dental. El uso de la tecnología de transferencia genética ofrece un enfoque potencialmente novedoso para manipular vías bioquímicas específicas y localizadas implicadas en la generación de dolor. La transferencia génica puede ser particularmente útil para controlar el dolor crónico e intratable. Varios estudios en modelos animales han demostrado que la transferencia mediada por virus de genes que codifican péptidos opiáceos a neuronas periféricas y centrales puede conducir a efectos antinociceptivos. Se necesita más investigación antes de que la transferencia de genes pueda analizarse clínicamente como una estrategia para el tratamiento del dolor crónico. El uso de la transferencia de genes en lugar del suministro de fármacos para lograr la liberación continua de péptidos bioactivos de vida corta en el cuerno dorsal espinal o cerca de él subyace a las estrategias más comunes para la terapia génica del dolor. Se ha intentado la inyección intratecal de vectores derivados de adenovirus, AAV o plásmidos encapsulados en lípidos que codifican interleuquina-10, neuronas transductoras de los ganglios de la raíz dorsal mediante inyección de vectores basados en el virus del herpes simple y virus vector inyectable portador del gen de un opioide endógeno. para controlar el dolor crónico También se ha encontrado que la administración directa de genes a la superficie articular de la articulación temporomandibular es factible. La investigación en esto puede dar lugar a nuevas estrategias de tratamiento para el dolor temporomandibular crónico [ También se ha encontrado que la administración directa de genes a la superficie articular de la articulación temporomandibular es factible. La investigación en esto puede dar lugar a nuevas estrategias de tratamiento para el dolor temporomandibular crónico [ También se ha encontrado que la administración directa de genes a la superficie articular de la articulación temporomandibular es factible. La investigación en esto puede dar lugar a nuevas estrategias de tratamiento para el dolor temporomandibular crónico .
Vacunación de ADN
Los científicos dentales han tratado de utilizar la tecnología clásica de vacunación para erradicar la caries dental o las enfermedades periodontales, logrando hasta ahora un éxito mixto. El enfoque moderno consiste en administrar directamente ADN en un plásmido en lugar de la administración tradicional de una proteína purificada o un microbio atenuado. La capacidad de inducir una respuesta inmune a un antígeno de proteína mediante la administración de ADN plasmídico que codifica el antígeno se ha demostrado con éxito en modelos animales. Las aplicaciones de la vacunación con ADN están en las primeras etapas de su uso con los tejidos orofaríngeos. La vacunación con ADN desempeñará un papel en las estrategias futuras para prevenir las enfermedades periodontales y la caries dental. La inmunización de la glándula salival utilizando ADN plasmídico que codifica el gen fimbrial Porphyromonas gingivalis conduce a la producción de proteína fimbrial localmente en el tejido de la glándula salival con producción consiguiente de inmunoglobulina A o IgA salival, inmunoglobulina G o IgG, anticuerpos y anticuerpos séricos IgG. . También se puede lograr la generación de linfocitos T citotóxicos específicos del antígeno dando como resultado la protección de P. gingivalis. Además, cualquier proteína fimbrial secretada en la saliva podría unirse a los componentes de la película y también inhibir la unión de P. gingivalis a la placa en desarrollo. Se ha informado que el plásmido pCIA-P que codifica el gen pac de S.mutans podría inducir respuestas inmunitarias anticaries protectoras en ratas mediante inmunización dirigida de las glándulas salivales [ e inmunoglobulina G, o IgG, anticuerpos y anticuerpos séricos IgG. También se puede lograr la generación de linfocitos T citotóxicos específicos del antígeno dando como resultado la protección de P. gingivalis. Además, cualquier proteína fimbrial secretada en la saliva podría unirse a los componentes de la película y también inhibir la unión de P. gingivalis a la placa en desarrollo. Se ha informado que el plásmido pCIA-P que codifica el gen pac de S.mutans podría inducir respuestas inmunitarias anticaries protectoras en ratas mediante inmunización dirigida de las glándulas salivales [ e inmunoglobulina G, o IgG, anticuerpos y anticuerpos séricos IgG. También se puede lograr la generación de linfocitos T citotóxicos específicos del antígeno dando como resultado la protección de P. gingivalis. Además, cualquier proteína fimbrial secretada en la saliva podría unirse a los componentes de la película y también inhibir la unión de P. gingivalis a la placa en desarrollo. Se ha informado que el plásmido pCIA-P que codifica el gen pac de S.mutans podría inducir respuestas inmunitarias anticaries protectoras en ratas mediante inmunización dirigida de las glándulas salivales . Las futuras estrategias de investigación deben dirigirse en esta dirección para prevenir las enfermedades periodontales y la caries dental.
Queratinocito
Los queratinocitos son las células que están presentes en la mucosa oral. Varias características hacen que los queratinocitos epidérmicos y de la mucosa sean atractivos para el tratamiento de trastornos tisulares locales y como agentes genéticos sistémicos. La presencia de células madre en los queratinocitos también es una ventaja. Son de fácil acceso y, por lo tanto, la monitorización puede ser precisa. La evaluación preclínica se puede realizar con precisión ya que se establecen modelos de cultura. Los procedimientos para trasplantar láminas de queratinocitos se establecen debido a su aplicación para pacientes con quemaduras. Es reversible porque el tejido genéticamente modificado puede extirparse. Los queratinocitos orales cultivados se han injertado en defectos quirúrgicos orales. Persisten en estos sitios y muestran una morfología epitelial normal. La expresión de genes terapéuticos se puede lograr con el uso de agentes aplicados tópicamente. Se ha demostrado la capacidad de los queratinocitos humanos transducidos para sintetizar y secretar proteínas recombinantes biológicamente activas. La hormona de crecimiento humana, la apolipoproteína E y el factor IX de la cascada de la coagulación se liberan con éxito mediante queratinocitos genéticamente modificados. La terapia génica se puede utilizar para tratar los trastornos de los queratinocitos y los trastornos dermatológicos, como la ictiosis y la epidermolisis bullosa . Los avances en la futura investigación de la terapia génica pueden usar queratinocitos para tratar enfermedades.
Glándulas salivales
Las glándulas salivales producen una gran cantidad de proteínas y son sitios fácilmente accesibles para la transferencia de genes con mínima invasividad a través de la canulación intraductal. La apertura del conducto principal en la cavidad oral se canula y los vectores de administración génica, virales o no virales, se infunden mediante una inyección retrógrada. Las glándulas salivales están encapsuladas, lo que minimiza el acceso indeseable de vectores administrados y transgenes a otros tejidos. El objetivo es proporcionar terapia génica a pacientes con disfunción irreversible de la glándula salival como resultado de irradiación para cánceres de cabeza y cuello o del daño autoinmune que se produce con el síndrome de Sjögren al aumentar las secreciones salivales transfiriendo genes que codifican proteínas secretoras en las glándulas salivales. Las proteínas se secretan posteriormente de una manera exocrina. Las glándulas salivales son tejidos secretores y las aplicaciones locales (oral, faríngea y esofágica) de terapias génicas se pueden lograr a través de la secreción exocrina de productos transgénicos en la saliva. Las glándulas salivales también se pueden utilizar para la terapia génica para trastornos sistémicos de deficiencia de proteína única . Un estudio demostró que la terapia génica con IL-27 mejora la exocrinopatía autoinmune del síndrome de Sjögren .
Cáncer oral
La estrategia general en el tratamiento del cáncer es expresar un producto genético que dará como resultado la muerte de células cancerosas. Se puede lograr con :
• Adición de un gen supresor tumoral (terapia de adición génica);
• Eliminación de un gen tumoral defectuoso (terapia de escisión genética);
• Regulación negativa de la expresión de genes que estimulan el crecimiento tumoral;
• Mejora de la vigilancia inmune (inmunoterapia);
• Activación de pro-fármacos que tienen un efecto quimioterapéutico y causan toxicidad solo para las células tumorales (terapia génica “suicida”);
• Introducción de genes para inhibir la angiogénesis tumoral;
• “Vacunación contra el cáncer” con genes para antígenos tumorales [ 21 ].
El objetivo de la terapia génica en el cáncer es introducir nuevo material genético en las células cancerosas que matarán selectivamente a las células cancerosas, sin causar toxicidad a las células normales circundantes. La principal preocupación sobre el uso de vectores de transferencia génica con pacientes, que tienen enfermedad autoinmune, es la posibilidad de una reacción inmunológica al vector. Vectores tales como adenovirus son útiles para terapia génica de cánceres de cabeza y cuello. Los vectores de Virus asociados a Adeno son mucho menos inmunogénicos que los vectores adenovirales. El gen supresor tumoral p53 es un gen que se elimina o muta en más del 50% de los cánceres humanos. La incidencia de mutaciones de p53 en los cánceres de cabeza y cuello se cree que es mayor en la enfermedad recurrente. La sustitución de un gen p53 mutado con un gen p53 de tipo salvaje (normal) es un enfoque potencial para el tratamiento del cáncer de cabeza y cuello. Otro gen supresor tumoral que podría ser reemplazado en la terapia contra el cáncer de cabeza y cuello es p16, ya que en el carcinoma de células escamosas del cáncer de cabeza y cuello, 80% a 90% de los casos muestran inactivación p16. Se cree que la inactivación de p16 es uno de los primeros pasos en la carcinogénesis por cáncer de cabeza y cuello y, por lo tanto, puede ser un objetivo ideal para la terapia de reemplazo génico. Se descubrió que la transferencia genética del gen p27 inhibe el ciclo celular de las células tumorales, induciendo la apoptosis y desencadenando la supresión del crecimiento tumoral . Se ha demostrado que las mutaciones del gen p27 están altamente relacionadas con la aparición de cáncer de lengua. Los genes supresores de tumores p16, p21, p27 y Rb con frecuencia están mutados en el cáncer de cabeza y cuello y, por lo tanto, son posibles objetivos de terapia génica . Un nuevo método es la terapia de profármacos enzimáticos dirigida por genes. En este se genera un virus recombinante que codifica una enzima activadora de profármacos tal como nitroreductasa, timidina quinasa o citosina desaminasa. Una vez entregada a la célula tumoral, la enzima puede convertir un profármaco inofensivo (administrado localmente o sistémicamente) en un fármaco citotóxico altamente tóxico. Un ejemplo es el gen de la timidina quinasa del virus del herpes simple (HSV) que transforma el ganciclovir en fosfato de ganciclovir. El fármaco activado es capaz de sangrar fuera de la célula infectada por virus para matar las células circundantes no infectadas, creando un efecto de “presencia” en el cáncer. Algunos virus, como el virus de la estomatitis vesicular, tienen la capacidad natural de infectar y replicarse selectivamente en las células tumorales. La terapia génica con estos tipos de vectores de virus atenuados con promotores específicos de tumores integrados en ellos puede causar oncólisis. La mutación genética ya presente en las células tumorales da como resultado la replicación del virus, la lisis celular, la diseminación del virus y la destrucción del tumor . Aumentar la sensibilidad del tumor a los procesos terapéuticos normales mediante la supresión de la actividad de NF-kB con el uso de la terapia génica también es un buen enfoque. El NF-kB parece contribuir a la progresión y metástasis de diversos cánceres, incluido el CEOS, por lo tanto su inhibición puede ser un tratamiento coadyuvante útil en la terapia del cáncer oral . Los estudios futuros pueden utilizar estrategias multigene para dirigirse a múltiples vías en las células cancerosas .
Movimiento de dientes de ortodoncia
El movimiento dental depende de la remodelación del hueso alveolar, que está controlado por osteoclastos y osteoblastos. La terapia génica con osteoprotegerina (OPG) y RANKL se ha utilizado para inhibir y acelerar el movimiento dental ortodóncico en un modelo de rata. La transferencia del gen RANKL local al tejido periodontal aceleró el movimiento del diente de ortodoncia en aproximadamente un 150% después de 21 días, sin provocar ningún efecto sistémico. Por lo tanto, puede ser útil para acortar el tratamiento de ortodoncia y también para mover los dientes anquilosados. La transferencia local de genes OPG inhibió el movimiento dental en aproximadamente un 50% después de 21 días de aplicación forzada . En el futuro, el ortodoncista puede usar procedimientos similares para reducir el tiempo de tratamiento y mejorar los resultados.
Terapia génica para hacer crecer nuevos dientes
Este enfoque generalmente se presenta en términos de agregar moléculas para inducir la iniciación de dientes de novo en la boca. Podría combinarse con la regeneración dental manipulada por genes; es decir, las células endógenas dentales in situ pueden activarse o reprimirse mediante una técnica de administración de genes para producir un diente. Se sabe que más de 200 genes se expresan durante el desarrollo del diente. El Baylor College of Medicine ha encontrado PAX 9, un gen maestro crítico para el desarrollo de los dientes. la represión de novo o la activación de genes como RUNX2 o USAG-1 podrían usarse para estimular la tercera dentición con el fin de inducir la formación de nuevos dientes en el ratón .Los investigadores dentales también pueden aspirar a desarrollar dientes en el laboratorio que puedan implantarse en la boca de pacientes que han perdido sus dientes naturales de otra manera. Estos dientes serían sin nervios y vasos sanguíneos, pero estarían hechos de las mismas sustancias que los dientes humanos. Para lograr esto, los investigadores deben encontrar los genes responsables de construir las 25 proteínas principales que componen las estructuras dentales. Además, puede haber docenas de otros genes involucrados en instruir al cuerpo sobre cuándo, cómo y dónde formar un diente en particular. Puede haber hasta un 10% del número total de genes implicados de algún modo en la formación de los dientes . La esperanza es que los investigadores puedan bioingeniería de dientes humanos para su reemplazo en el futuro.
Cirujano dental como gen terapeuta
El papel del cirujano dental en la terapia génica es sostenible. Una ventaja principal para los dentistas en los estudios de terapia génica es la accesibilidad fácil de los tejidos orales. La cavidad oral sirve como una ventana conveniente para el cuerpo. Si las aplicaciones de la transferencia génica oral se expanden a las enfermedades sistémicas, los proveedores de atención médica oral en el futuro podrían ser rutinariamente “terapeutas genéticos” con objetivos terapéuticos bien fuera de la cavidad oral. El cirujano dental tiene un enfoque fácil para áreas como las glándulas salivales y los queratinocitos (epitelio oral). Las glándulas salivales son sitios diana excelentes para la transferencia génica, que se logran fácilmente de manera mínimamente invasiva. Hay aproximadamente 500-1000 glándulas salivales menores en la cavidad oral. La glándula salival produce una gran cantidad de proteínas y es un sitio donde la transferencia génica se puede lograr de manera mínimamente invasiva. Las glándulas salivales podrían usarse para aplicaciones terapéuticas génicas con deficiencias proteínicas únicas. La disfunción irreversible de las glándulas salivales debido a enfermedades autoinmunes e irradiación también puede corregirse mediante la terapia génica. Los queratinocitos son las células que están presentes en la mucosa oral. Varias características hacen que los queratinocitos epidérmicos y de la mucosa sean atractivos para el tratamiento de trastornos tisulares locales y como agentes genéticos sistémicos. La expresión de genes terapéuticos se puede lograr con el uso de agentes aplicados tópicamente. El cirujano dental puede ser el mejor profesional para administrar la terapia génica en la cavidad oral que contiene glándulas salivales menores y queratinocitos. También con la investigación futura y los avances en la terapia génica, los pacientes con dolor intratable en cualquier parte del cuerpo pueden ingresar a la clínica dental para aliviar su dolor a través de la terapia génica.
Conclusiones y dirección futura
La terapia génica consiste esencialmente en la introducción de material genético específico en las células diana sin producir efectos tóxicos sobre el tejido circundante. El impedimento principal para la aplicación exitosa de la terapia génica para el tratamiento de una variedad de enfermedades no es la escasez de genes terapéuticos, sino la falta de un sistema eficaz de administración de genes no tóxicos. La investigación debería centrarse en la generación de vectores menos inmunogénicos con propiedades inmunogénicas reducidas y para evitar respuestas inflamatorias mediadas por vectores. El futuro de la terapia génica es excelente y alentador. La terapia génica tiene potencial y es una modalidad de tratamiento prometedora del número de enfermedades especialmente para cánceres de cabeza y cuello. Existen muchas afecciones que no ponen en peligro la vida y que afectan negativamente la calidad de vida del paciente, para las cuales no existen tratamientos efectivos. La capacidad del virus del herpes simple de residir en neuronas en un estado latente sin afectar la fisiología celular normal puede usarse en el futuro en el tratamiento de trastornos neurológicos. La tercera dentición que podría ser inducida localmente por la terapia génica para reemplazar los dientes perdidos presenta un concepto atractivo y desafíos para los investigadores. Comprender los mecanismos de la formación de dientes supernumerarios que literalmente representan la tercera dentición y aplicarla en la terapia génica ayudará a eliminar el problema de la pérdida de un diente. La falta de un tratamiento adecuado ha permitido que la morbilidad se convierta en una base racional para ampliar el alcance de la terapia génica. La tercera dentición que podría ser inducida localmente por la terapia génica para reemplazar los dientes perdidos presenta un concepto atractivo y desafíos para los investigadores. Comprender los mecanismos de la formación de dientes supernumerarios que literalmente representan la tercera dentición y aplicarla en la terapia génica ayudará a eliminar el problema de la pérdida de un diente. La falta de un tratamiento adecuado ha permitido que la morbilidad se convierta en una base racional para ampliar el alcance de la terapia génica. La tercera dentición que podría ser inducida localmente por la terapia génica para reemplazar los dientes perdidos presenta un concepto atractivo y desafíos para los investigadores. Comprender los mecanismos de la formación de dientes supernumerarios que literalmente representan la tercera dentición y aplicarla en la terapia génica ayudará a eliminar el problema de la pérdida de un diente. La falta de un tratamiento adecuado ha permitido que la morbilidad se convierta en una base racional para ampliar el alcance de la terapia génica.