Anemia falciforme
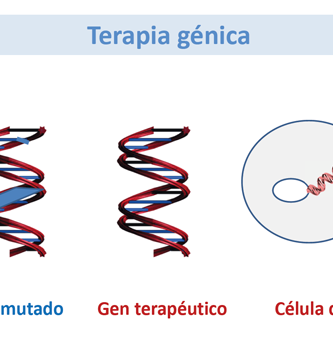
La enfermedad de células falciformes es un trastorno genético común que puede ser difícil de manejar y para el cual el trasplante de células madre es la única terapia curativa potencial. Se estima que alrededor de 25 millones de personas en todo el mundo padecen la enfermedad, con 300 000 pacientes nuevos cada año, la mayoría de los cuales vive en países de ingresos bajos y medianos. Aunque el tratamiento puede aliviar el dolor y ayudar a controlar los síntomas, la enfermedad de células falciformes puede tener una carga sustancial en la calidad de vida de un individuo, particularmente durante las crisis de dolor. Como un trastorno típicamente monogenético, la enfermedad de células falciformes se ha considerado durante mucho tiempo un candidato lógico para la terapia génica. Se ha logrado un progreso sustancial hacia este objetivo, aunque estas técnicas aún están lejos de estar listas para implementarse en el paciente cotidiano en todo el mundo.
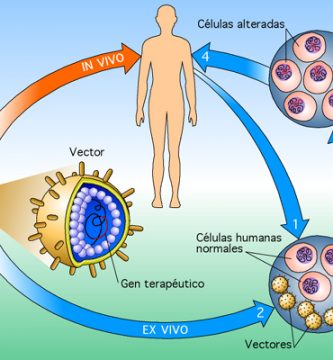
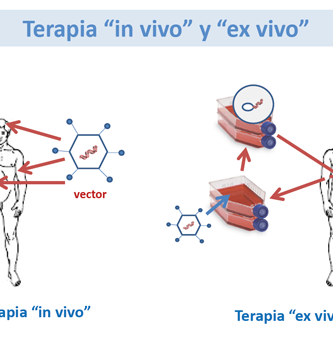
Elizabeth Traxler y colaboradores han utilizado el sistema de edición CRISPR / Cas9 para promover la expresión de la hemoglobina fetal en las células sanguíneas tomadas de pacientes con enfermedad de células falciformes. Dado que los trastornos tales como la enfermedad de células falciformes y la β-talasemia se vuelven sintomáticos cuando la expresión de la hemoglobina cambia de la γ-globina fetal a la β-globina adulta mutada, la promoción de la expresión de la forma fetal podría elevar potencialmente el fenotipo falciforme de las células. Traxler y sus colegas demostraron que al mutar una secuencia de 13 nucleótidos que está presente en los promotores de los genes HBG1 y HBG2, podrían replicar una persistencia hereditaria natural de la mutación asociada a la hemoglobina fetal. También con el objetivo de aumentar la expresión de la hemoglobina fetal, pero por diferentes medios, Christian Brendel y sus colegas redujeron la expresión del represor de hemoglobina fetal BCL11A por ARN de horquilla corta específica de linaje en ratones. Otros estudios de la terapia génica para la enfermedad de células falciformes y la β-talasemia han intentado insertar una β-globina funcional en las células madre hematopoyéticas de un paciente ex vivo a través de un vector de lentivirus. Las células se devolvieron a los pacientes mediante un autotrasplante de células madre. Los primeros datos de ensayos clínicos presentados en la reunión anual de la Sociedad Estadounidense de Hematología indicaron que, para algunos pacientes, la β-globina funcional introducida se expresó y dio como resultado la independencia de la transfusión, pero no para todos los pacientes tratados.
La entrega eficiente y segura a las células y tejidos diana ha sido el desafío de larga data para las estrategias exitosas de terapia génica. Los vectores virales a menudo se utilizan para administrar componentes de terapia génica; sin embargo, en el caso de la tecnología CRISPR / Cas9, esta administración podría conducir a la expresión persistente de la enzima de corte de ADN Cas9, que podría dar como resultado una escisión fuera del objetivo. Un reciente estudio murino de Hao Yin y sus colegas utilizaron una mezcla de métodos de administración virales y no virales para administrar la terapia génica. El ARN guía de CRISPR y la plantilla de reparación genética se introdujeron a través de un vector de adenovirus, lo que permitió que se expresaran durante un período prolongado de tiempo. Cas9 fue entregado por una nanopartícula de lípidos, que permite la expresión a corto plazo de Cas9, y podría reducir el riesgo de posibles cortes fuera de objetivo por el sistema CRISPR / Cas9. Los efectos fuera del objetivo son una gran preocupación para la tecnología CRISPR / Cas9; las mutaciones pueden ocurrir cuando una sección involuntaria de ADN se escinde. Incluso si la expresión de Cas9 es limitada, la unión fuera del objetivo por CRISPR puede ser una preocupación. Los genomas de dos personas no son idénticos, y los métodos para identificar la unión potencial fuera del objetivo tienden a basarse en genomas compuestos o de referencia. Estos métodos pueden indicar que no hay sitios de enlace fuera del objetivo, pero este puede no ser el caso en la realidad.
A pesar de estas preocupaciones, el primer ensayo clínico de EE. UU. Que involucra tecnología CRISPR ha pasado una revisión de seguridad inicial por los Institutos Nacionales de Salud en junio de este año. La prueba, que comenzará en 2017, pendiente de la aprobación de la Administración de Alimentos y Fármacos de EE. UU. Y los comités de ética locales, utilizará la tecnología CRISPR para editar PD-1 y TCR de células T de pacientes con mieloma múltiple, melanoma o sarcoma. En experimentos murinos, la técnica CRISPR dio como resultado cierta expresión residual de PD-1 y TCR, pero a niveles suficientemente bajos para hacer que las células T modificadas apunten a las células cancerosas de manera más efectiva que aquellas con expresión completa. Estas células T editadas se devolverán al paciente con el objetivo de atacar y eliminar el cáncer.
La terapia génica algún día podría proporcionar una cura para la enfermedad de células falciformes, pero la tecnología aún se encuentra en etapas clínicas y preclínicas muy tempranas. No obstante, también ha habido avances en el tratamiento de la enfermedad de células falciformes sin terapia génica, como un mejor control del dolor, transfusiones profilácticas, hidroxiurea y la continuación de la investigación de fármacos experimentales como los modificadores de la hemoglobina anti-sickling. Hasta que la terapia génica llegue a buen término, estos tratamientos representan la mejor oportunidad para el manejo global mejorado de la enfermedad de células falciformes.