La terapia génica germinal implica la introducción de genes en las células somáticas y en la línea germinal de un individuo. El resultado no es solo que el individuo está curado de la enfermedad genética, sino que algunos de los gametos del individuo también pueden tener el rasgo alterado. La terapia génica germinal en ratones ha tenido éxito, pero hasta ahora los protocolos desarrollados para su uso en ratones no han sido efectivos en humanos. Un protocolo que podría ser factible en la terapia génica germinal humana implica la extracción de un embrión durante la etapa de blastocito de desarrollo e inyección con células transgénicas. A medida que el embrión desarrolla las células inyectadas, se integran en los tejidos del cuerpo, incluida la línea germinal y, finalmente, los gametos de ese individuo (Griffiths 1996).
Terapia génica somática
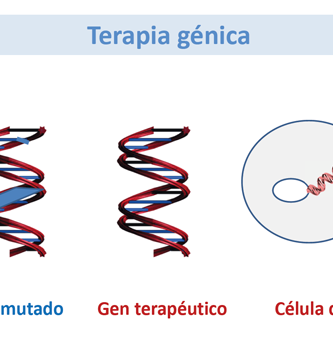
La terapia génica somática se centra en la corrección de enfermedades genéticas mediante el tratamiento de tejidos no reproductivos o somáticos. Este método de terapia génica implica la eliminación de algunas de las células disfuncionales y la inserción de un gen clonado de tipo salvaje. Las células transgénicas se reintroducen en el cuerpo del paciente donde proporcionan la función del gen corregido. En la mayoría de los casos, no todas las células afectadas deben alterarse, sino solo lo suficiente para aliviar los síntomas de la enfermedad. A diferencia de la terapia génica germinal, la tecnología de la terapia génica somática ha avanzado rápidamente y actualmente se está evaluando en numerosos ensayos clínicos (Griffiths 1996). La terapia génica somática actualmente se enfoca en tratar aquellas enfermedades que están limitadas a un solo tejido, incluyendo la FQ y la ADA. Pronto la terapia somática se puede usar en enfermedades multigénicas (Msezane 1997, Marshall 1995). Sin embargo, la debilidad de la terapia génica somática radica en el suministro del gen de tipo salvaje y la expresión sostenedora (Verma 1997).
Gene entrega
En la actualidad, hay dos tipos de vehículos de administración de genes, no virales y virales. La administración de genes no virales incluye enfoques tales como la inyección directa o la mezcla del ADN con compuestos que permiten que el gen cruce la membrana celular, pero estos tipos de sistemas de administración de genes no han sido eficaces. La administración de genes con vectores virales ha tenido más éxito y la mayoría de los protocolos actuales implican este tipo de entrega de genes. La administración de genes virales implica el uso de un virus que ha sido desactivado patógenamente, pero aún mantiene su capacidad natural para transferir ADN a las células vivas (Verma 1997, Msezane 1997, Crystal 1995).
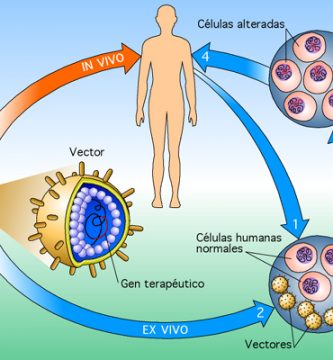
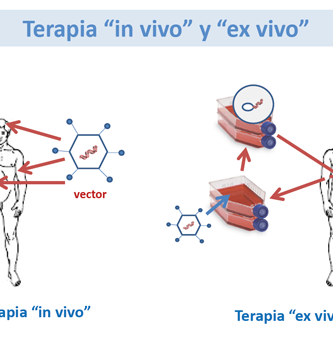
Los retrovirus son un grupo de virus ARN que convierten su genoma en ADN en la célula huésped infectada. Los investigadores han identificado regiones del genoma viral que son necesarias para la integración en el genoma del huésped y para controlar la expresión génica. Mediante la manipulación de estas regiones del genoma viral y la sustitución de porciones con transgenes, los investigadores han podido utilizar los virus para administrar de manera efectiva genes de tipo salvaje. Los vectores retrovirales solo tienen la capacidad de infectar células que se dividen rápidamente, y no pueden infectar las células que componen el tejido muscular, cerebral, pulmonar y hepático. En un procedimiento llamado terapia génica ex vivo, las células del tejido diana se eliminan y crecen in vitro donde pueden infectarse con el vector retrovírico alterado. Las células transgénicas se vuelven a trasplantar en el paciente donde expresan el producto génico deseado. Sin embargo, la expresión génica cesa después de aproximadamente una semana a pesar de la presencia continuada de las células que poseen el ADN transgénico. Se ha observado una expresión génica más prolongada en otros sistemas, y la solución puede implicar encontrar la combinación potenciador-promotor correcta para un tipo de célula dado. Los lentivirus son virus que pertenecen a la familia de los retrovirus, pero que pueden infectar tanto a las células en división como a las que no se dividen. El lentivirus mejor conocido es el virus de la inmunodeficiencia humana (VIH), que ha sido desactivado y desarrollado como un vector de administración de genes in vivo. Los lentivirus pueden manipularse de manera similar a los retrovirus y parecen mantener la expresión durante más de seis meses. Otra ventaja de los lentivirus es que no provocan una respuesta inmune celular efectiva (Verma 1997, Msezane 1997, Crystal 1995).
Los adenovirus son una familia de virus de ADN que pueden infectar tanto las células en división como las que no se dividen. Tras la infección, el genoma del adenovirus no se integra en el ADN del huésped, sino que se replica como elementos cromosómicos adicionales en el núcleo del huésped (Crystal 1995 Verma 1997). El proceso de replicación de estos virus se puede inhabilitar y manipular el genoma para que el virus exprese un gen deseable muy parecido a los vectores que se han discutido anteriormente. Sin embargo, a diferencia de los retrovirus, los adenovirus pueden infectar células in vivo y expresar los productos del gen trans a niveles elevados. La respuesta inmune del huésped generalmente da como resultado una duración corta (<10 días) de la expresión del gen y en la producción de anticuerpos que hacen que los tratamientos adicionales con el virus recombinante sean casi inútiles. Por otra parte, un gran porcentaje de la población humana ya tiene anticuerpos para Adenovirus debido a la presencia natural previa en infecciones.