El concepto de transferir genes a tejidos para aplicaciones clínicas se ha discutido durante casi medio siglo, pero nuestra capacidad para manipular material genético a través de la tecnología de ADN recombinante ha llevado a este objetivo a la realidad. Aunque originalmente se concibió como una forma de tratar trastornos potencialmente mortales (errores congénitos, cánceres) refractarios al tratamiento convencional, la terapia génica ahora se considera para muchas afecciones que no ponen en peligro la vida, incluidas las que afectan negativamente a la calidad de vida del paciente. La falta de un tratamiento adecuado se ha convertido en una base racional para ampliar el alcance de la terapia génica. Este manuscrito revisa los métodos generales mediante los cuales se transfieren los genes, así como diversos ejemplos de aplicaciones clínicas (daño tisular adquirido, infección del tracto gastrointestinal superior, enfermedad autoinmune, deficiencia de proteína sistémica). A pesar de algunos problemas bien publicitados, la terapia génica ha logrado un progreso sustancial, incluido un éxito tangible, aunque mucho más lento de lo que se había predicho inicialmente. Aunque la terapia génica todavía se encuentra en una etapa bastante primitiva, está firmemente basada en la ciencia. Existe un optimismo justificable que con el aumento de la comprensión patobiológica y las mejoras biotecnológicas, la terapia génica se convertirá en una parte estándar de la práctica clínica en 20 años.
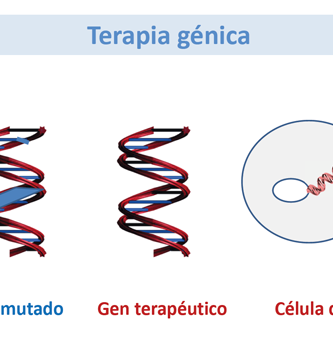
La terapia génica generalmente implica la inserción de un gen funcional en las células para corregir una disfunción celular o para proporcionar una nueva función celular ( Culver, 1994 ). Por ejemplo, enfermedades como la fibrosis quística, los síndromes de inmunodeficiencia combinados, la distrofia muscular, la hemofilia y muchos cánceres son el resultado de la presencia de genes defectuosos. La terapia génica se puede utilizar para corregir o reemplazar los genes defectuosos responsables. La terapia génica ha sido especialmente exitosa en el tratamiento de los síndromes de inmunodeficiencia combinados, demostrando beneficios terapéuticos duraderos y notables ( Cavazzana-Calvo et al., 2000 ; Cavazzana-Calvo et al., 2001 ; Cavazzana-Calvo y Fischer, 2007 ).
Sin embargo, es importante recordar que la terapia génica no es una idea nueva. En 1963, Joshua Lederberg escribió, “Podríamos anticipar el. . . intercambio de cromosomas y segmentos. La última aplicación de la biología molecular sería el control directo de las secuencias de nucleótidos en los cromosomas humanos, junto con el reconocimiento, la selección y la integración de los genes deseados. . . . Solo será una cuestión de tiempo. . . antes de que las secuencias de polinucleótidos puedan ser injertadas mediante procedimientos químicos en un ADN de virus. “Menos de 30 años después, se informó el primer estudio clínico usando transferencia de genes ( Rosenberg et al., 1990) Rosenberg y sus colegas utilizaron un vector retroviral para transferir el gen marcador de resistencia a la neomicina a los linfocitos infiltrantes de tumores obtenidos de 5 pacientes con melanoma metastásico. Estos linfocitos se expandieron in vitro y luego se reinfundieron en los respectivos pacientes. Dado que este primer estudio demostró que la transferencia de genes retrovirales era segura y práctica, condujo a muchos otros estudios. De hecho, desde 1989, se han aprobado más de 900 ensayos clínicos en todo el mundo ( Edelstein et al., 2004 ). Lo que hizo posible la terapia genética entre 1963 y 1990 fue el desarrollo de la tecnología del ADN recombinante.
Vectores
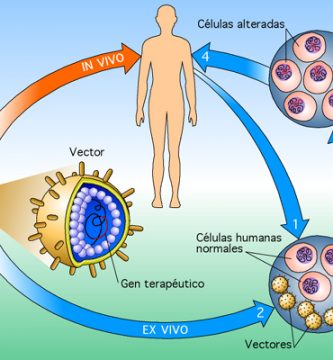
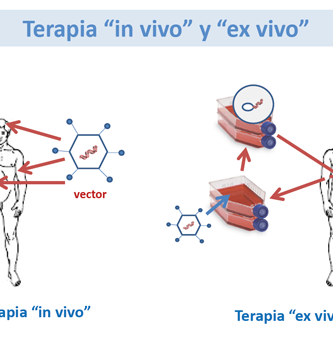
Hay dos enfoques generales para introducir genes en una célula: viral y no viral ( Tabla 1 ). Los vectores virales se han utilizado en ~ 70% de los ensayos clínicos hasta la fecha ( Edelstein et al., 2004 ). Los vectores virales son extremadamente eficientes en la transferencia de genes, pero pueden crear algunos riesgos de seguridad. La transferencia génica mediada por vectores virales se denomina transducción. Los vectores no virales se consideran mucho más seguros que los vectores virales, pero en la actualidad son bastante ineficaces para transferir genes. La transferencia génica mediada por vectores no víricos se denomina transfección.
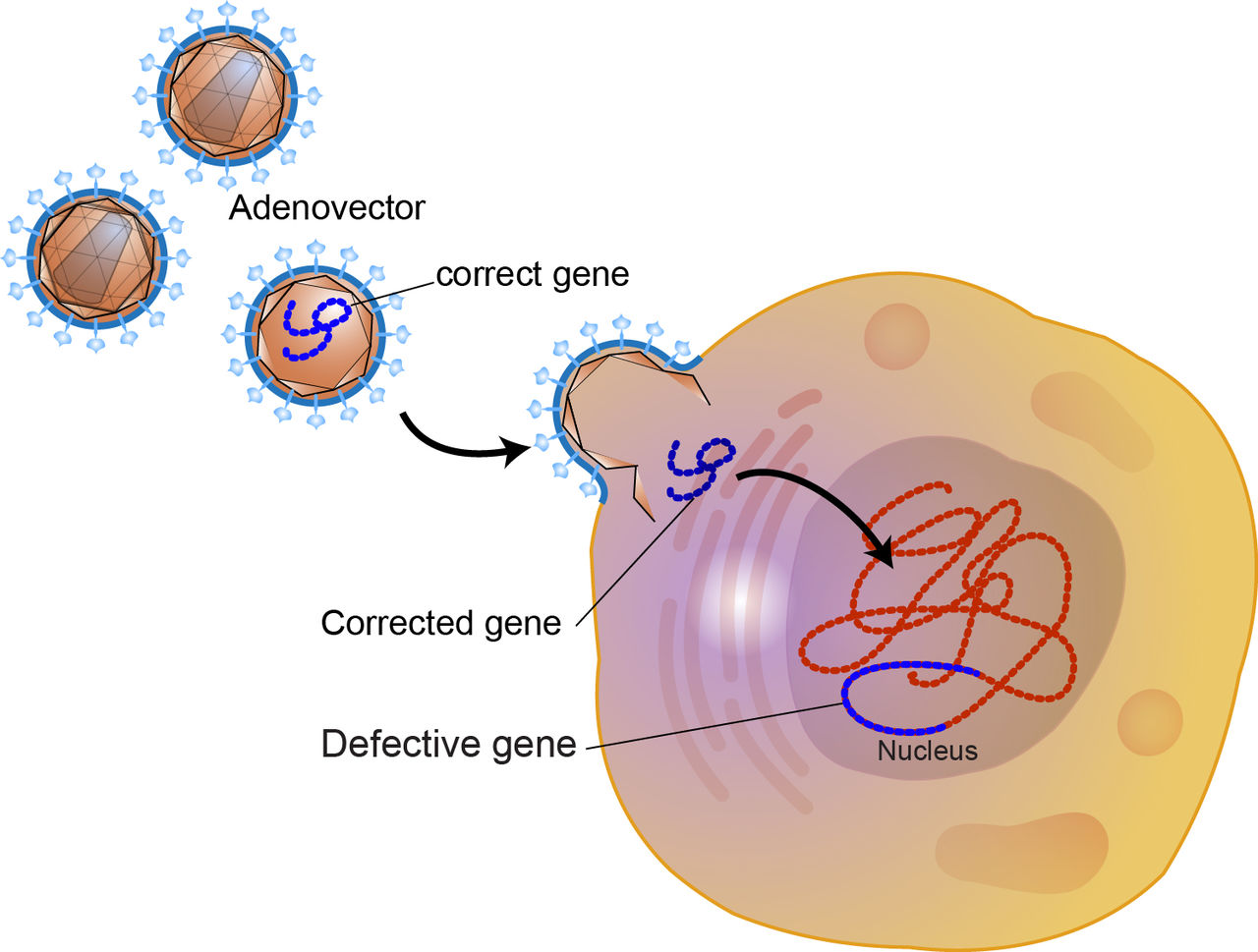
Como se indicó, los vectores virales tienen la ventaja de lograr una transferencia de genes altamente eficaz in vivo. Aunque se usan vectores deficientes en replicación, los vectores virales aún plantean problemas de seguridad significativos. Los dos vectores virales más comunes utilizados en ensayos clínicos han sido los derivados de un adenovirus de serotipo 5 (Ad5; ~ 26%) y el virus de la leucemia murina de Moloney (MoMLV; ~ 28%), un retrovirus. Los vectores MoMLV se dirigen a las celdas divisorias con un grado razonablemente alto de eficiencia. Es importante destacar que también conducen a la transferencia de genes estable porque se integran aleatoriamente en los cromosomas de la célula objetivo. Una desventaja principal de los vectores MoMLV es el riesgo de mutagénesis por inserción causada por la integración del genoma retroviral en el genoma del huésped. Además, dado que los vectores retrovirales requieren la división de las células para la transducción exitosa, no son útiles para dirigir la transferencia de genes a tipos de células quiescentes bien diferenciadas, como en los tejidos epiteliales. Los vectores Ad5 pueden transducir células que se dividen y no se dividen y facilitan la transferencia de genes altamente eficiente. Es importante destacar que los vectores Ad5 muy rara vez se integran en un cromosoma, es decir, que existen en un núcleo de células diana en una ubicación epicromosómica. Por lo tanto, si la célula diana se divide, solo una célula hija recibirá el gen transferido, y con los siguientes ciclos de división celular, el gen se diluirá de forma espectacular. La principal desventaja de los vectores Ad5 es que inducen una potente respuesta inmune del huésped. También es importante reconocer que los diferentes vectores virales variarán en su capacidad para transducir diferentes tipos de células. A menudo,
De los enfoques de transferencia génica no viral desarrollados, dos métodos se han utilizado con bastante frecuencia en ensayos clínicos. Una implica simplemente la inyección directa de plásmidos que contienen el transgén (denominado “ADN desnudo”) en un tejido. Esto se ha usado en ~ 14% de los ensayos clínicos aprobados, con mayor frecuencia en el músculo. El segundo método usa lípidos catiónicos (denominados liposomas) para rodear el ADN del plásmido y se denomina lipofección. Este método se ha usado en ~ 9% de los ensayos aprobados. Los lípidos catiónicos facilitan la entrada del plásmido en la célula. La transferencia de genes no virales típicamente no da como resultado la integración del transgén.
El tejido blanco-glándulas salivales
Nuestros estudios se han centrado en la transferencia de genes a las glándulas salivales (SG). Se trata de órganos encapsulados cuya función principal es secretar líquido y proteínas en la cavidad oral y el tracto gastrointestinal superior (GI) a través de la saliva. Es importante destacar que, aunque se consideran glándulas exocrinas clásicas, los SG también pueden secretar proteínas en el torrente sanguíneo. Los SG tienen una considerable capacidad para producir proteínas, lo que facilita su función protectora y digestiva en la boca y el tracto gastrointestinal superior ( Amerongen y Veerman, 2002 ). Los humanos tienen seis SG principales (la parótida bilateral, submandibular y sublingual) y numerosas glándulas menores. Un tratamiento de terapia génica para SG implica la transferencia de un nuevo gen a través de la canulación retroductal de los conductos excretores principales de un SG principal. Esto podría conducir a la producción de una proteína terapéutica celular (Baum et al., 2006 ; Kok et al., 2003 ) o a la secreción en la saliva o en el torrente sanguíneo ( Voutetakis et al., 2005 ; Wang et al., 2005 ). La canulación de los conductos excretores principales de los principales SG es un procedimiento bastante simple que se utiliza de forma rutinaria en la clínica para radiografías de contraste (sialogramas). Este es un método de administración muy eficaz porque prácticamente todas las células epiteliales en SG son continuas con el sistema de conductos. Como los SG en humanos son órganos encapsulados, los vectores administrados a través del sistema ductal están limitados para llegar a otros órganos o al torrente sanguíneo.
En estudios preclínicos, los animales son anestesiados antes del procedimiento de canulación para la restricción solamente; no se necesita anestesia clínicamente. En ratones y ratas, por lo general, nos dirigimos a las glándulas submandibulares para la transferencia de genes, ya que sus conductos son más fáciles de canular que los de las glándulas parótidas. Sin embargo, en cerdos en miniatura y primates no humanos, nos enfocamos en las glándulas parótidas por su facilidad y conveniencia, y porque están bien encapsuladas. El volumen en el que se suspende el vector para la administración varía de acuerdo con el tamaño del animal ( Tabla 2 ). Por ejemplo, para administrar vectores a una glándula submandibular de ratón, usamos 50 μl de tampón de suspensión. Por el contrario, para administrar un vector a la glándula parótida de un cerdo en miniatura, utilizamos un volumen de 4.000 μ1.
Para nuestras aplicaciones de estudios de terapia génica a SG (descritos a continuación), hemos utilizado principalmente vectores virales adenoasociados (AAV2) de Ad5 y serotipo 2 ( Tabla 3 ). Los vectores Ad5 pueden transducir hasta ~ 40% de prácticamente todos los tipos de células en SG, y median en una expresión transgénica robusta a corto plazo, con expresión máxima a ~ 48-72 horas. Típicamente, debido a que los vectores Ad5 provocan una respuesta inmune potente, la expresión transgénica se reduce drásticamente después de 7 a 10 días y se reduce a niveles de fondo en 14 días ( Kagami et al., 1998 ). Los vectores AAV2 transducen principalmente células ductales y requieren ~ 8-12 semanas para alcanzar niveles máximos de expresión transgénica ( Voutetakis et al., 2004 ). Los vectores AAV2 provocan solo una respuesta inmune modesta, y la expresión transgénica en ratones es bastante estable (Voutetakis y otros, 2004 ; Voutetakis et al., 2005 ).