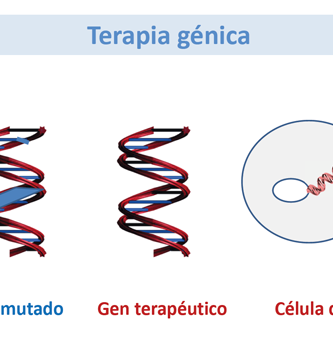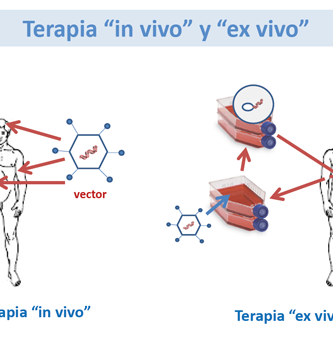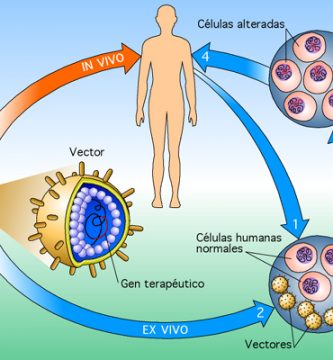
La Terapia Génica y la Terapia Celular se superponen campos de investigación biomédica con objetivos terapéuticos similares. La Terapia Genética puede definirse como el uso de material genético (generalmente ácido desoxirribonucleico – ADN) para manipular las células de un paciente para el tratamiento de una enfermedad heredada o adquirida. La Terapia Celular puede definirse como la infusión o trasplante de células enteras en un paciente para el tratamiento de una enfermedad heredada o adquirida.
El concepto de terapia génica se introdujo a finales de los años setenta después del desarrollo de la tecnología del ADN recombinante. En este momento, muchos enfoques para la terapia genética se están evaluando en modelos animales de enfermedades humanas y en ensayos clínicos. Si bien no ha habido aplicaciones completamente exitosas de la terapia génica para las enfermedades humanas, se han logrado progresos considerables. En comparación con la terapia génica, la terapia celular es una disciplina más antigua, que se remonta a las primeras transfusiones de sangre en la década de 1940, y procediendo a través de órganos y trasplante de médula ósea en los años 1960 y 70, a la más moderna transferencia adoptiva de linfocitos para tratar el cáncer y la Potencial de utilizar células madre para reparar los órganos dañados en el futuro.
Un ejemplo clásico de la Terapia Génica son los esfuerzos para corregir la hemofilia. La hemofilia A y la hemofilia B son causadas por deficiencias de los factores de coagulación factor VIII (FVIII) y factor IX (FIX), respectivamente. FVIII y FIX se hacen en el hígado y se secretan en la sangre donde tienen papeles críticos en la formación de coágulos en los sitios de la lesión del vaso. Las mutaciones en los genes FVIII o FIX previenen la formación de coágulos y los pacientes con hemofilia corren un grave riesgo de hemorragia. Utilizando portadores de virus discapacitados, los investigadores han podido introducir genes FVIII y FIX normales en el músculo y el hígado de modelos animales de hemofilia, y en el caso de FIX, pacientes humanos.
Los genes transferidos funcionan, y en los modelos animales producen suficiente proteína para corregir los problemas de sangrado. Los estudios iniciales en seres humanos han sido cautelosos, pero han demostrado que el procedimiento es seguro y que el gen transferido hace FIX. La terapia génica para la hemofilia podría proporcionar una alternativa rentable a la necesidad repetida de que los pacientes de hemofilia sean inyectados con FVIII recombinante o FIX, así como evitar las complicaciones de contaminar proteínas o patógenos en las proteínas inyectadas. Un obstáculo recurrente que se ha identificado en los estudios en animales es que cuando FVIII o FIX se hace en animales que nunca han tenido estas proteínas, el sistema inmune de huéspedes puede reconocer el nuevo FVIII o FIX como una proteína extraña y desarrollará anticuerpos contra ella. Un área activa de investigación actualmente es determinar la mejor manera de tratar simultáneamente con la transferencia de genes y la respuesta inmune.
Actualmente, la terapia celular más común (que no sea transfusiones de sangre) es el trasplante de médula ósea. El trasplante de médula ósea es el tratamiento de elección para muchos tipos de leucemia y linfoma y se usa para tratar muchos trastornos hereditarios que van desde las talasemias relativamente comunes (deficiencias de alfa-globina o beta-globina, los componentes de la hemoglobina) hasta trastornos más raros como la inmunodeficiencia combinada severa (SCID, la enfermedad del “chico burbuja”). La clave para el trasplante de médula ósea es la identificación de un buen donante “inmunológico compatible”. Las células de la médula ósea del paciente son destruidas luego por quimioterapia o radiación y las células del donante compatible son infundidas. Las células más primitivas de la médula ósea, llamadas células madre, encuentran su camino hacia la médula ósea donde se duplican para aumentar su número (auto-renovación) y también proliferan y maduran produciendo un número normal de células sanguíneas derivadas del donante en la circulación del paciente en unas pocas semanas. Desafortunadamente, no todos los pacientes tienen una buena “concordancia inmunológica”. Además, hasta un tercio (dependiendo de varios factores incluyendo la enfermedad) de los injertos de médula ósea no repoblan completamente al paciente, y la destrucción de la médula ósea del huésped puede ser letal, particularmente en pacientes muy enfermos. Estos factores se combinan para contener el evidente potencial del trasplante de médula ósea.
Terapia génica y terapia celular se superponen en el tratamiento de SCID. Los dos tipos de SCID que han sido tratados con terapia génica son ADA-SCID, causada por mutaciones incapacitantes en el gen de Adenosina Deaminasa, y X-SCID, causado por mutaciones incapacitantes en el gen de la cadena gamma del receptor de IL-2, también llamado común Cadena gamma (c). Los pacientes con deficiencia de ADA o c no tienen linfocitos T (las células que reconocen proteínas extrañas y pocas o disfuncionales células B (las células que producen anticuerpos) .Los pacientes SCID son por lo tanto incapaces de montar una respuesta inmune a los patógenos comunes, el tratamiento de elección para los pacientes es un trasplante de médula ósea de la patente con el mejor partido inmunológico, si no hay un padre igualado (~ 25% del tiempo) o el trasplante no tiene éxito ( Los pacientes con cáncer de próstata pueden ser sometidos a la terapia génica y los virus eviscerados que contienen los genes ADA o c se introducen en las células de la médula ósea del paciente y las células tratadas se devuelven al paciente.
En algunos casos recientes de SCID deficiente en ADA, la infusión fue precedida por un leve agotamiento de las células de la médula ósea del paciente. En estos primeros estudios, se demostró claramente que las células madre de médula ósea se marcó con el nuevo gen, y la transferencia del gen hecho ADA o c. En varios pacientes con SCA ADA que también recibieron un leve agotamiento de la médula ósea, surgieron suficientes células T y B productoras de ADA que estos pacientes ya no necesitan la inyección suplementaria de enzima ADA purificada. En los pacientes con XSCID, los niños de 10/11 comenzaron a producir células T funcionales y desarrollaron anticuerpos cuando se vacunaron contra las enfermedades comunes de la infancia. Recientemente, dos de estos pacientes han desarrollado una leucemia de células T que está asociada con la inserción del gen c en un gen de leucemia conocido, dando como resultado una moratoria en otros intentos de realizar terapia génica para X-SCID.
Otro ejemplo de superposición de células y terapias genéticas es el uso de linfocitos T para tratar el cáncer. Muchos tumores son reconocidos como extraños por las células T del paciente, pero estas células T no expanden sus números lo suficientemente rápido para matar el tumor. Las células T que se encuentran en el tumor pueden crecer fuera del cuerpo hasta números muy altos y luego infundirse en el paciente, causando a menudo una reducción dramática en el tamaño del tumor. Este tratamiento es especialmente eficaz para los tumores que se han diseminado, ya que los linfocitos específicos del tumor los rastrearán dondequiera que estén. La adición del gen a las células T puede permitir que se seleccionen células T específicas que puedan ser asesores de tumores más eficaces y un segundo gen que pueda usarse para matar las células T expandidas después de haber realizado su trabajo.